基本信息
基本信息-
中文名称Lipo6000 转染试剂
-
中文别名脂质体6000
-
英文名称Lipo6000 Transfection Reagent
-
保存温度2-8℃
-
有效期1年
 产品简介
产品简介1.Lipo6000™转染试剂(Lipo6000™ Transfection Reagent)是一种非常高效的新型转染试剂,达到了国际最主流转染试剂的转染效果。适用于把质粒、siRNA或其它形式的核酸包括DNA、RNA、寡核苷酸、以及核酸蛋白复合物或带负电荷的蛋白转染到真核细胞中,也可以用于活体动物的核酸转染以用于基因治疗。
2.Lipo6000™转染试剂对于常见的哺乳动物细胞具有非常高的转染效率、重复性好、操作简单、无明显的细胞毒性,并且对于贴壁细胞和悬浮细胞都适用。
3.Lipo6000™转染试剂的使用方法和常用的Lipofectamine®2000 Reagent基本一致。并且经过对HEK293T、Hela、NIH3T3、HEK293FT、CHO等细胞的测试,转染效率也和Lipofectamine® 2000 Reagent相当甚至略高。
4.Lipo6000™转染试剂不仅适用于质粒、siRNA等单一成分的细胞转染,也适合多个质粒或者质粒与siRNA等的组合转染。
5.Lipo6000™转染试剂转染过表达质粒后,通常24-48小时后达到较高的蛋白表达水平,并且很多情况下蛋白表达量在转染后48小时显著高于转染后24小时;转染siRNA通常3-5天后对于目的基因的下调水平会比较理想。
6.Lipo6000™转染试剂转染细胞时,基本不受细胞培养液中的血清和抗生素的影响,即可以在血清和抗生素存在的情况下进行细胞转染。但为了取得最佳的转染效果,推荐转染时使用不含抗生素的含血清的细胞培养液。
7.Lipo6000™转染试剂的转染效果可以通过转染表达EGFP等荧光蛋白的质粒进行快速鉴定。
 操作方法(仅供参考)
操作方法(仅供参考)一、 DNA转染
1. 细胞培养(以六孔板为例,其它培养板或培养皿可参考六孔板):在转染前一天(18-24小时)按照每孔约20-70万细胞(具体的细胞数量据细胞类型、大小和细胞生长速度等而定)接种到六孔板内进行培养,使第二天细胞密度能达到约70-90%。
2. 在进行下述转染步骤前,把培养有细胞的六孔板每孔换成2ml新鲜培养液(含有血清,不含抗生素)。可以使用含有血清并含有抗生素的新鲜培养液,但抗生素的存在对于有些细胞容易导致转染后出现一定的细胞毒性。
3. 参考下表,对于待转染的六孔板中每一个孔的细胞,取两个洁净无菌离心管,分别加入125µl不含抗生素和血清的DMEM培养液(高糖DMEM或低糖DMEM均可)或Opti-MEM® Medium,然后于其中一管加入2.5µg质粒DNA,并用枪轻轻吹打混匀;另一管加入5µl Lipo6000转染试剂,用枪轻轻吹打混匀,请特别注意不可Vortex或离心。室温静置5分钟后(通常最长不宜超过25分钟),将含有DNA的培养液用枪轻轻吹打混匀,室温静置5分钟(室温存放6小时内稳定)。
| 96-well | 48-well | 24-well | 12-well | 6-well | 6cm | 10cm | ||
| Lipo6000转染试剂 | 0.2μl | 0.5μl | 1μl | 2μl | 5μl | 10μl | 30μl | |
| 无血清培养液或Opti-MEM® Medium | 5μl | 12.5μl | 25μl | 50μl | 125μl | 250μl | 750μl | |
| DNA | 100ng | 250ng | 500ng | 1μg | 2.5μg | 5μg | 15μg | |
| 无血清培养液或Opti-MEM® Medium | 5μl | 12.5μl | 25μl | 50μl | 125μl | 250μl | 750μl | |
| 稀释好的Lipo6000转染试剂和DNA分别室温静止放置5分钟,随后两者混合并混匀再室温静止放置5分钟 | ||||||||
| 每孔加入的混合物的量 | 10μl | 25μl | 50μl | 100μl | 250μl | 500μl | 1500μl | |
| 按照上述用量每孔均匀滴加Lipo6000转染试剂和DNA的混合物,4-6小时后更换培养液或直接继续培养 | ||||||||
注1:对于六孔板中一个孔的细胞,Lipo6000转染试剂的用量可以在3-12.5μl范围内进行适当调节,DNA用量建议固定在2.5
μg,但也可以在1-4μg的范围内进行适当调节。通常质粒用量(μg)和Lipo6000™(μl)的用量比例为1:2或1:3比较常用,如有必要
可以在1:0.5-1:5的范围内优化转染效果,上表推荐的比例为1:2,此时Lipo6000的用量相对较少,既经济又高效。最佳的转
染条件,因不同的细胞类型和培养条件而有所不同,可以在上述推荐范围内自行优化转染条件。注2:质粒的浓度宜控制在0.5-5μg/μl范围内。
注3:对于多个孔转染相同数量相同质粒的情况可以把每个孔所需的Lipo6000转染试剂和DNA混合物分别配制,然后一起混
合在同一个离心管内,后续混匀并孵育5分钟后,可以按照推荐用量滴加到细胞培养器皿内。
注4:对于其它培养板或培养器皿,各种试剂的用量可以按照细胞培养器皿的培养面积按比例进行换算。如果转染寡核苷酸或
RNA等可以参考转染DNA的条件进行。
4. 无论是贴壁细胞还是悬浮细胞,按照六孔板每孔250µl Lipo6000转染试剂-DNA混合物的用量,均匀滴加到整个孔内,随后轻轻混匀。
5. 为达到最高的转染效率,细胞在转染后培养4-6小时后宜更换为新鲜的完全培养液(对于Hela细胞,推荐在转染4小时后更换培养液,对于NIH3T3、CHO、HEK293T和HEK293FT细胞,推荐在转染6小时后更换培养液)。
6. 继续培养约24-48小时后,即可用适当方式检测转染效果,例如荧光检测、Western、ELISA、报告基因等,或加入适当的筛选药物如G418等进行稳定细胞株的筛选。
二、siRNA转染
1. 细胞培养(以六孔板为例,其它培养板或培养皿可参考六孔板):在转染前一天(18-24小时)按照每孔约20-70万细胞(具体的细胞数量据细胞类型、大小和细胞生长速度等而定)接种到六孔板内进行培养,使第二天细胞密度能达到约30-50%。
2. 在进行下述转染步骤前,把培养有细胞的六孔板每孔换成2ml新鲜培养液(含有血清,不含抗生素)。可以使用含有血清并含有抗生素的新鲜培养液,但抗生素的存在对于有些细胞容易导致转染后出现一定的细胞毒性。
3. 参考下表,对于待转染的六孔板中每一个孔的细胞,取两个洁净无菌离心管,分别加入125µl不含抗生素和血清的DMEM培养液(高糖DMEM或低糖DMEM均可)或Opti-MEM® Medium,然后于其中一管加入100pmol siRNA,并用枪轻轻吹打混匀;而另一管加入5µl Lipo6000转染试剂,用枪轻轻吹打混匀,请特别注意不可Vortex或离心。室温静置5分钟后(通常最长不宜超过25分钟),将含有siRNA的培养液用枪轻轻加入含Lipo6000转染试剂的培养液中,轻轻颠倒离心管或者用枪轻轻吹打混匀,室温静置5分钟(室温存放6小时内稳定)。
| 96-well | 48-well | 24-well | 12-well | 6-well | 6cm | 10cm | ||
| Lipo6000转染试剂 | 0.2μl | 0.5μl | 1μl | 2μl | 5μl | 10μl | 30μl | |
| 无血清培养液或Opti-MEM® Medium | 5μl | 12.5μl | 25μl | 50μl | 125μl | 250μl | 750μl | |
| siRNA | 4pmol | 10pmol | 20pmol | 40pmol | 100pmol | 200pmol | 600pmol | |
| 无血清培养液或Opti-MEM® Medium | 5μl | 12.5μl | 25μl | 50μl | 125μl | 250μl | 750μl | |
| 稀释好的Lipo6000转染试剂和siRNA分别室温静止放置5分钟,随后两者混合并混匀再室温静止放置5分钟 | ||||||||
| 每孔加入的混合物的量 | 10μl | 25μl | 50μl | 100μl | 250μl | 500μl | 1500μl | |
| 按照上述用量每孔均匀滴加Lipo6000转染试剂和siRNA的混合物,4-6小时后更换培养液或直接继续培养 | ||||||||
注1:对于六孔板中一个孔的细胞,Lipo6000转染试剂的用量可以在2.5-7.5μl范围内进行适当调节,siRNA用量可以在50-250pmol的范围内进行适当调节。通常siRNA用量(pmol)和Lipo6000(μl)的用量比例为20:1,如有必要可以在10:1-40:1的范围内优化转染效果,上表推荐的比例为20:1,此时Lipo6000的用量相对较少,既经济又高效。最佳的转染条件,因不同的细胞类型和培养条件而有所不同,可以在上述推荐范围内自行优化转染条件。注2:siRNA的推荐浓度为20µM,常用的浓度范围为10-50µM。注3:对于多个孔转染相同数量相同质粒的情况可以把每个孔所需的Lipo6000转染试剂和siRNA混合物分别配制,然后一起混合在同一个离心管内,后续混匀并孵育5分钟后,可以按照推荐用量滴加到细胞培养器皿内。注4:对于其它培养板或培养器皿,各种试剂的用量可以按照细胞培养器皿的培养面积按比例进行换算。如果转染寡核苷酸或RNA等可以参考转染DNA的条件进行。
4. 无论是贴壁细胞还是悬浮细胞,按照六孔板每孔250µl Lipo6000转染试剂-siRNA混合物的用量,均匀滴加到整个孔内,随后轻轻混匀。
5. 为达到最高的转染效率,细胞在转染后培养4-6小时后宜更换为新鲜的完全培养液(对于Hela细胞,推荐在转染4小时后更换培养液,对于NIH3T3、CHO、HEK293T和HEK293FT细胞,推荐在转染6小时后更换培养液)。
6. 继续培养3-5天后,即可用适当方式检测siRNA对于靶基因的下调效果,例如qPCR、Western、ELISA、报告基因等。
 注意事项
注意事项1. 使用高纯度的DNA或RNA有助于获得较高的转染效率。
2. 转染前细胞必须处于良好的生长状态。
3. 需自备不含抗生素的无血清培养液或Opti-MEM®培养液或普通的DMEM培养液。
4. Lipo6000转染试剂不能vortex或离心,宜缓慢晃动混匀。
5. Lipo6000转染试剂使用后请立即盖好盖子,避免长时间暴露在空气中,影响转染效率。
6. 本产品仅供科研使用。请勿用于医药、临床诊断或治疗,食品及化妆品等用途。请勿存放于普通住宅区。
7. 为了您的安全和健康,请穿好实验服并佩戴一次性手套和口罩操作。
8. 实验结果可由多种因素影响,相关处理只限于产品本身,不涉及其他赔偿。
备注:由于产品信息可能会有优化升级。请以实际收货标签信息为准。
 附表
附表常用多孔板和培养皿的尺寸、培养面积、细胞培养量和推荐的培养体积等相关数据表: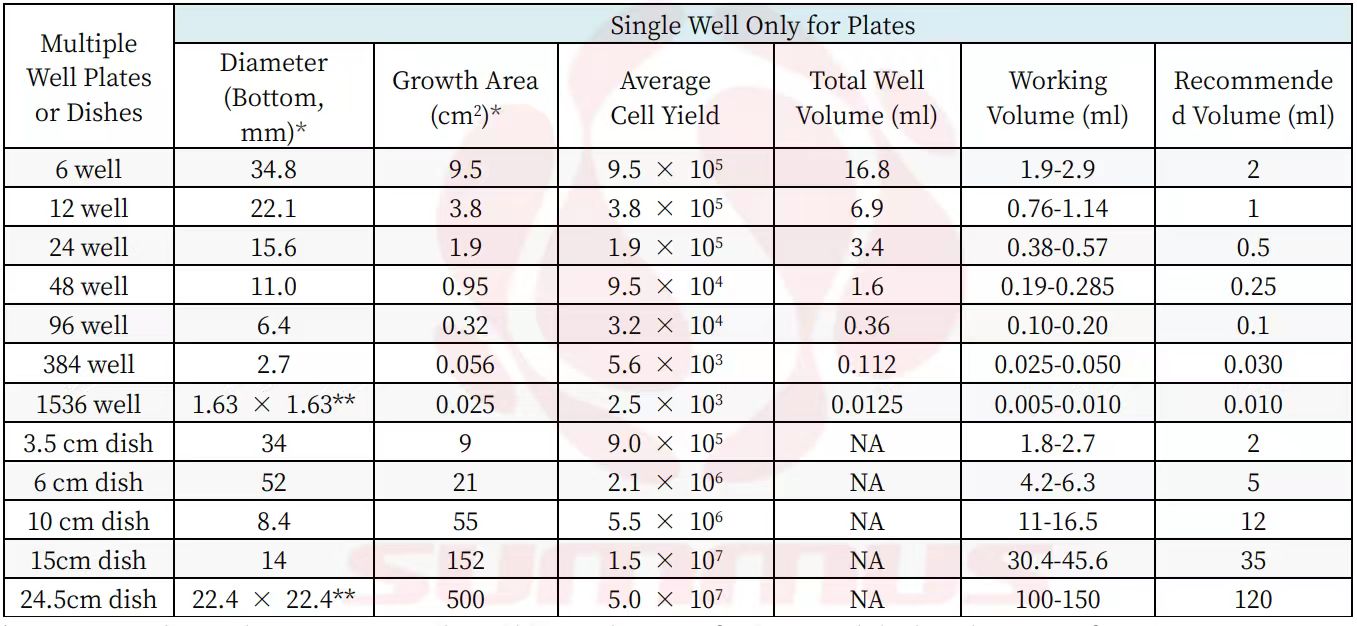
*Diameter and growth area may vary depending on the manufacturer, and the listed sizes are from Corning.
**These wells or dishes are square.





 申请试用
申请试用